![]()
KRAS es la oncoproteína que se encuentra mutada de forma más frecuente en el cáncer. Si se ataca a los directores o a los mensajeros de KRAS se podría anular su efecto.
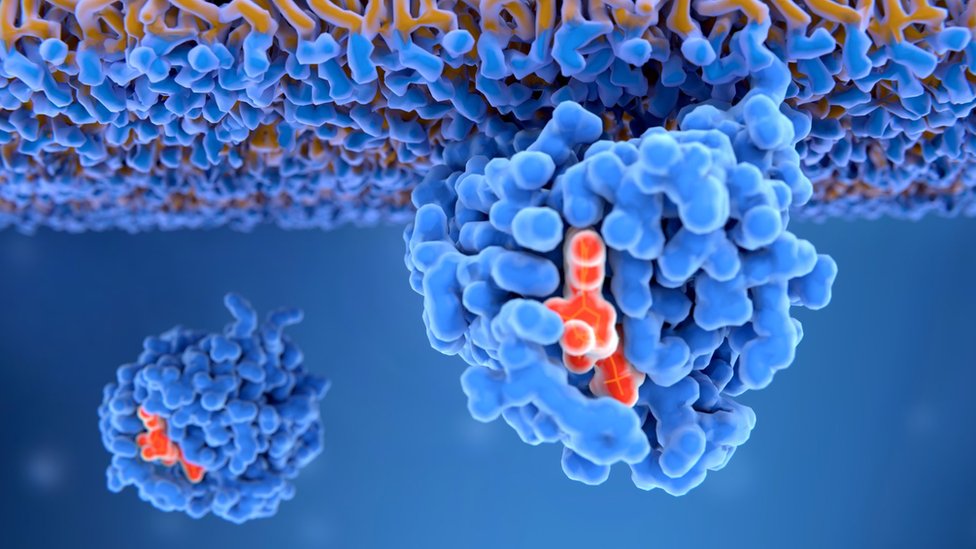
Cuando una célula sufre una mutación en un protooncogén -gen que en su estado normal regula el crecimiento y la división celulares- que se convierte en un oncogén, puede comenzar a transformarse en una célula tumoral.
Si el sistema inmunitario detecta esa célula mutada y es capaz de eliminarla, o si la propia célula localiza el error y se suicida, no supondrá ninguna amenaza.
Pero si a esa mutación se suman otros cambios en el genoma de la célula que bloquean la apoptosis o suicidio celular, y le permiten pasar inadvertida para el sistema inmunitario, surgirá un cáncer.
Uno de los oncogenes que se encuentra frecuentemente mutado en varios tumores, incluyendo el cáncer de pulmón, colorrectal o de páncreas, es el KRAS (abreviación de oncogén homólogo al virus Kirsten de sarcoma de rata).
Objetivo prioritario desde hace 40 años
La proteína codificada por este gen forma parte de la familia de las oncoproteínas RAS (HRAS, NRAS y KRAS).
De las tres, KRAS es maldita, ya que se encuentra mutada de forma más frecuente en el cáncer: está presente en aproximadamente 1 de cada 4 pacientes.
Por este motivo ha sido uno de los principales objetivos terapéuticos en la lucha contra esta enfermedad desde su descubrimiento en 1982.
Las mutaciones en la proteína KRAS se concentran en una de sus moléculas constituyentes, el aminoácido 12 -aunque también puede darse en el 13 y el 61-, y desencadenan la activación permanente de la proteína.
Como consecuencia, se activan más de 10 cascadas de señalización implicadas en la proliferación tumoral y la metástasis.
Desde su hallazgo se han estudiado múltiples estrategias para intentar bloquear la actividad de KRAS mutada, pero hacerlo de forma directa ha mostrado una gran complejidad, tanto por las propias características de la proteína como por la elevada toxicidad generada por los fármacos.
Por eso, la aprobación de inhibidores de KRAS como tratamientos se ha hecho esperar cuatro décadas.
Por fin llegan los primeros fármacos
En mayo de 2021, el primer inhibidor de KRAS recibía la aprobación de la Administración de Alimentos y Medicamentos de Estados Unidos (FDA).
Actúa específicamente frente a la mutación KRASG12C para el tratamiento del cáncer de pulmón y lleva el nombre comercial de Sotorasib (AMG510).
Meses más tarde, en enero de 2022, la Agencia Europea de Medicamentos (EMA) daba también su visto bueno al Sotorasib.
Además, la FDA está evaluando la aprobación de otro inhibidor frente a la misma mutación, el Adagrasib (MRTX 849), que podría ser comercializado en breve.
La mutación G12C (que consiste en el cambio del aminoácido glicina en la posición 12 por una cisteína) es la más frecuente en los pacientes de cáncer de pulmón no microcítico con KRAS mutado, que representan aproximadamente el 13% del total de pacientes con este tipo de cáncer.
También está presente en algunos enfermos con cáncer colorrectal y de páncreas, aunque en un porcentaje mucho menor.
En la actualidad existen más de un centenar de ensayos clínicos en pacientes con cáncer de pulmón y colorrectal para probar fármacos que bloqueen KRAS o las proteínas relacionadas con su actividad.
Una de las dianas relevantes para frenar el efecto de esta oncoproteína es el receptor del factor de crecimiento epidérmico (EGFR), que es el mitógeno responsable de la activación de KRAS. O dicho de otro modo, la señal que enciende la proteína.
Dianas alternativas
A pesar de que la proteína KRAS mutada ha sido un objetivo difícil desde el punto de vista farmacológico -e incluso considerada inaccesible durante varias décadas-, proteínas relacionadas con su activación han sido objeto de numerosos estudios como dianas alternativas y más asequibles.
Dichos trabajos han permitido ampliar el arsenal de fármacos experimentales para inhibir esta oncoproteína tan letal y sus colaboradores.
- Inhibidores de proteínas implicadas en la activación de KRAS. SHP2 es una fosfatasa (un tipo de enzima) conocida por promover la supervivencia de las células tumorales. Aunque los inhibidores desarrollados frente a esta molécula han mostrado una eficacia limitada como tratamiento único, su combinación con terapias dirigidas a otras proteínas ha permitido mejorar su efectividad. Otra molécula objeto de estudio es SOS1, que tiene un papel fundamental en la activación de KRAS. Su inhibición disminuiría la actividad de la proteína y favorecería la remisión del crecimiento tumoral.
- Inhibidores de proteínas activadas por KRAS. KRAS activa vías de señalización celular que permiten a las células tumorales sobrevivir, proliferar e invadir otros tejidos (metástasis). El bloqueo de esas vías mediante la inhibición de alguna de las proteínas implicadas -como ERK o mTOR- podrían permitir el control de la actividad protumoral de KRAS.
En otras palabras, si atacamos a los directores o a los mensajeros de KRAS podríamos anular su efecto.
Pero, al igual que en las películas de acción, cuando el protagonista intenta desactivar una bomba se ha de tener cuidado con el cable que se va a cortar.
Bloquear las proteínas que participan en la señalización de KRAS puede tener efectos secundarios importantes, ya que estas proteínas son relevantes también en otros procesos fisiológicos.
La lucha continúa
El principal reto actual es mejorar la eficacia de los inhibidores ya desarrollados.
La combinación entre ellos, o con diferentes fármacos antitumorales, podría ayudar no solo a diseñar terapias más eficientes, sino también a evitar la resistencia farmacológica que se produce cuando se usa un único agente terapéutico.

Otro desafío fundamental es buscar nuevos inhibidores que permitan silenciar KRAS, independientemente de su mutación concreta.
Una de las estrategias terapéuticas más prometedoras es la inmunoterapia, es decir, el uso del propio sistema inmunitario del paciente para atacar a las células tumorales que porten una o varias mutaciones.
Es el caso de las vacunas, en las que también hemos trabajado en nuestro grupo de investigación, o la terapia de células T (CART), o sea, glóbulos blancos del paciente reprogramados para atacar selectivamente las células malignas.
Y finalmente, la terapia génica mediante tecnología CRISPR/Cas9, dirigida a silenciar o reparar el gen mutado, también podría poner contra las cuerdas a esta oncoproteína tan esquiva.
El desarrollo de fármacos efectivos para bloquear KRAS y las vías de señalización relacionadas supondrá un hito muy importante en el tratamiento de numerosos tumores.
Incluso podría curar algunos cánceres que actualmente tienen un mal pronóstico, como el de páncreas.
*Rosana Simón Vázquez es doctora en Bioquímica y Biología Molecular. Investigadora en Nanomedicina e Inmunología, Universidade de Vigo. Lara Diego González es investigadora de apoyo a la investigación. Grupo de Trasplante y Autoinmunidad, Hospital Universitario Marqués de Valdecilla


Más noticias
Región de Los Lagos registra alza en creación de empresas y consolida dinamismo emprendedor durante 2025
Operación Centinela Austral: PDI desbarata red de narcotráfico en el sur con histórico decomiso de droga
Rápido operativo policial esclarece robo en colegio de Los Muermos